遺伝的複雑性と生活習慣の深淵
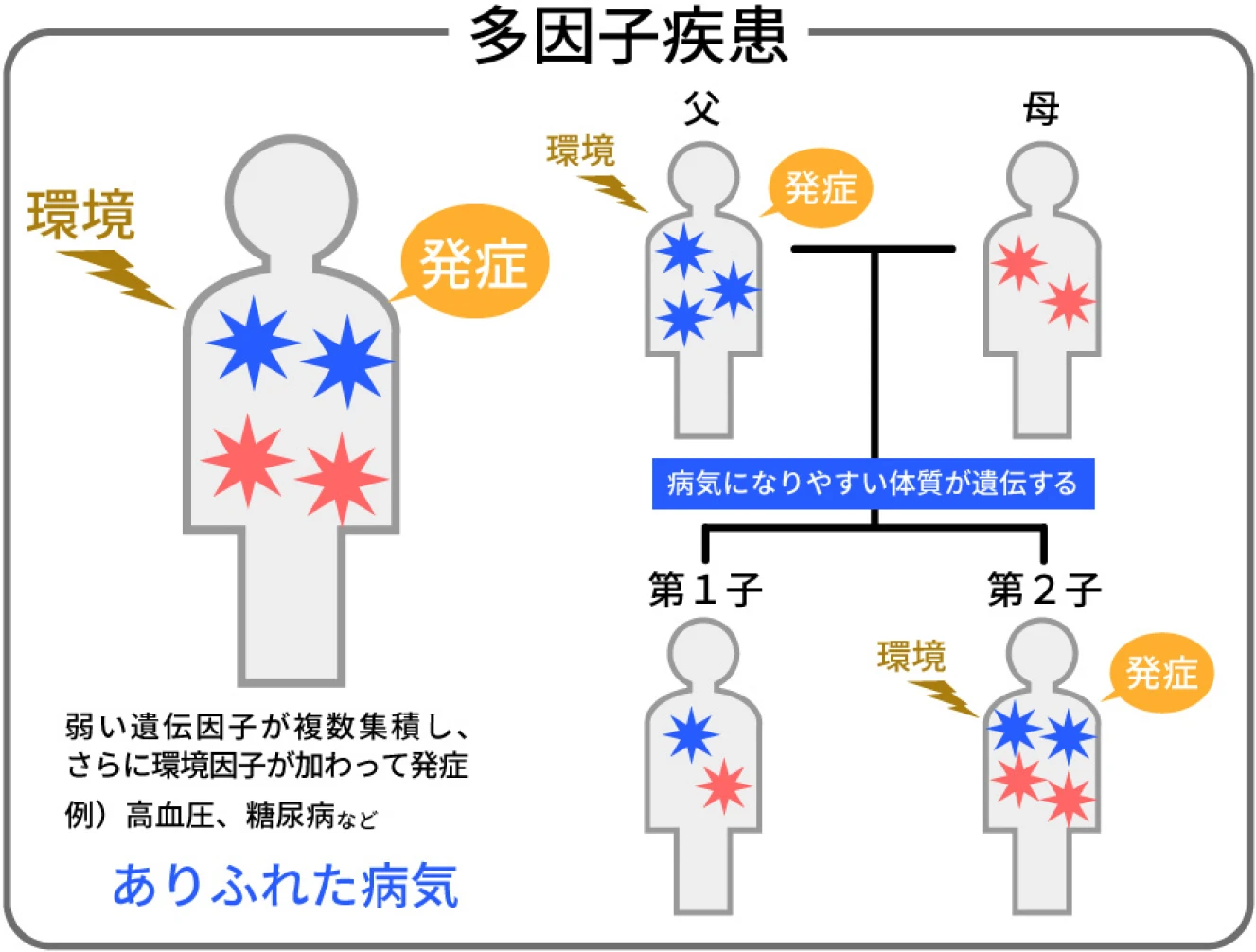
多遺伝子性疾患は、複数の遺伝子が関与する遺伝学の中でも非常に興味深く複雑な分野です。
単一の遺伝子の変異が疾患を引き起こす単一遺伝子疾患とは異なり、多遺伝子性疾患は、多くの遺伝子変異が相互に作用して発症に寄与します。
本ページでは、生活習慣病である高血圧や糖尿病に焦点を当てつつ、ゲノムワイド関連解析(GWAS)、一塩基多型(SNP)、連鎖解析、メンデルランダム化といった先進的な遺伝学研究技術を詳しく解説します。
多遺伝子性疾患の理解
多遺伝子性疾患の一般的な例として、心血管疾患、糖尿病、肥満、うつ病や統合失調症などがあります。
これらの疾患は、遺伝的要因と環境的要因の両方が影響するため、多因子性とされています。
また遺伝的要因も単一遺伝子疾患と異なり、多くの遺伝子の累積効果によって引き起こされます。
生活習慣病: 高血圧と糖尿病
【高血圧】
高血圧は、動脈内の血圧が持続的に高い状態が続く慢性的な疾患です。これは、心臓発作や脳卒中などの心血管疾患の主要なリスク要因です。
- 遺伝的要因
- 環境的要因
多くの遺伝子座が高血圧に関連しています。これらの遺伝子座には、腎臓のナトリウム処理、血管の緊張、レニン-アンジオテンシン系などの生理的プロセスを調節する遺伝子が含まれます。
塩分の多い食事、運動不足、ストレスなどの生活習慣が高血圧のリスクに大きく影響します。
【糖尿病】
糖尿病、特に2型糖尿病は、インスリン抵抗性やインスリン分泌不足による高血糖状態を特徴とする代謝性疾患です。
- 遺伝的要因
- 環境的要因
インスリン分泌やグルコース代謝に影響を与えるいくつかの遺伝子変異が特定されています。これらの遺伝子は、しばしば膵臓のβ細胞機能やインスリンシグナル伝達経路に関与しています。
食生活、肥満、運動不足は2型糖尿病の発症に重要な環境要因です。
一塩基多型(SNP)
【SNPとは何か?】
一塩基多型(Single Nucleotide Polymorphism, SNP)は、遺伝子の中で最も一般的な遺伝的変異の形式で、ゲノムの特定の位置におけるDNAを構成する単一の塩基(A、T、C、G)の違いを指します。 ヒトゲノムには約30億塩基対のDNAが含まれており、その中でSNPが約1,000万箇所知られています。これらの変異は、個人間の遺伝的多様性を形成する重要な要素です。
- ●SNPの検出方法
- ①DNAシーケンシング
- ②ジェノタイピングアレイ
- ●SNPのデータベース
- ①dbSNP
- ②1000 Genomes Project
SNPを検出するための技術は急速に進歩しています。一般的な方法には次のようなものがあります。
次世代シーケンシング(NGS)技術を使用して、大規模なゲノム全体のSNPを高速かつ正確に検出します。
特定のSNPをターゲットにしたアレイ技術を使用して、多数のSNPを一度に検出します。これらのアレイはコスト効率が高く、大規模な集団研究に適しています。
検出されたSNPは、データベースに登録しています。代表的なデータベースには以下のものがあります。
NCBIが提供するSNPのデータベースで、数百万のSNP情報が収録されています。
ヒトの遺伝的多様性を包括的にカバーするプロジェクトで、世界中の異なる集団から収集されたSNPデータが公開されています。
【SNPの分類】
SNPは、SNPのある場所の遺伝子機能に基づいて以下のように分類されます。
- ①コーディング領域SNP
- 同義SNP(Synonymous SNP)
- 非同義SNP(Nonsynonymous SNP)
- ②非コーディング領域SNP
遺伝子がコードするアミノ酸配列に影響を与えない変異。コードするアミノ酸は、3塩基(コドン)で20種類のアミノ酸をコードします。 そのため1つのアミノ酸をコードする塩基の組み合わせが複数ある物があります。たとえば、コドンGAAとGAGは両方ともグルタミン酸をコードします。 そのため3番目の塩基がAからGに変異したとしても、同じアミノ酸がコードされます。そのためコードされるアミノ酸配列に違いはありません。
遺伝子がコードするアミノ酸配列が変わる変異。 非同義SNPは、さらにミスセンス変異(遺伝子がコードするアミノ酸が別のアミノ酸に変わる)とナンセンス変異(アミノ酸が停止コドンに変わり、コードされるアミノ酸配列の途中で終わる)に分けられます。
遺伝子の発現場所や時期などを調節する領域(プロモーターやエンハンサー)やイントロン領域に位置する変異。
遺伝子のスプライシングや転写の効率に影響を与えることがあります。
【SNPの機能的影響】
SNPは遺伝子やタンパク質の機能に様々な影響を与えます。その影響は次のような影響があります。
- ①遺伝子発現の調節
- ②タンパク質の機能変更
- ③スプライシングの変化
調節領域に位置するSNPは、転写因子の結合やクロマチン構造の変化を通じて、遺伝子発現レベルを変えることがあります。
非同義SNPはタンパク質のアミノ酸配列を変えることで、その機能や安定性に影響を与えます。
イントロンとエクソンの境界に位置するSNPは、スプライシングのパターンを変える可能性があります。
【SNPの研究と応用】
- ①疾患関連研究
- GWAS
- 疾患リスク予測
- 機能的研究
- ②個別化医療
- ③進化と集団遺伝学
SNPを利用して疾患に関連する遺伝的変異を特定するための研究。特定のSNPと疾患の関連性を見つけることで、その疾患の発症メカニズムやリスク因子を明らかにします。GWASについては、次項でより詳細に説明いたします。
GWASの結果など特定のSNPの存在が特定の疾患のリスクを高めることが分かっている場合、個人のリスク評価に利用できます。
特定のSNPの違いが遺伝子機能にどのように影響するか調べることで、疾患の病理学的理解を深め、発症メカニズムを解明するための研究に使用することができます。
SNP情報を用いて、個々の患者に最適な治療法や薬剤を選定することが可能になります。例えば、薬物代謝に関与する遺伝子のSNPは、薬剤の効果や副作用に影響を与えるため、患者ごとに適切な投薬量を決定するのに役立ちます。
また多遺伝子性疾患のリスク評価や進行予想に影響を与えます。
SNPデータは、異なる集団間の遺伝的多様性を研究するために使用されます。
これにより、ヒトの進化や移住パターン、集団間の遺伝的関係を明らかにすることができます。
ゲノムワイド関連解析(GWAS)
GWASは、特定の疾患や特性に関連するSNPをゲノム全体でスキャンする研究です。疾患を持つ人と持たない人のゲノムを比較することで、疾患のリスクに寄与する遺伝的変異を特定できます。
GWASは、大規模なコホート(母集団)からDNAサンプルを収集し、高スループットのジェノタイピングを用いて数十万から数百万のSNPを解析します。
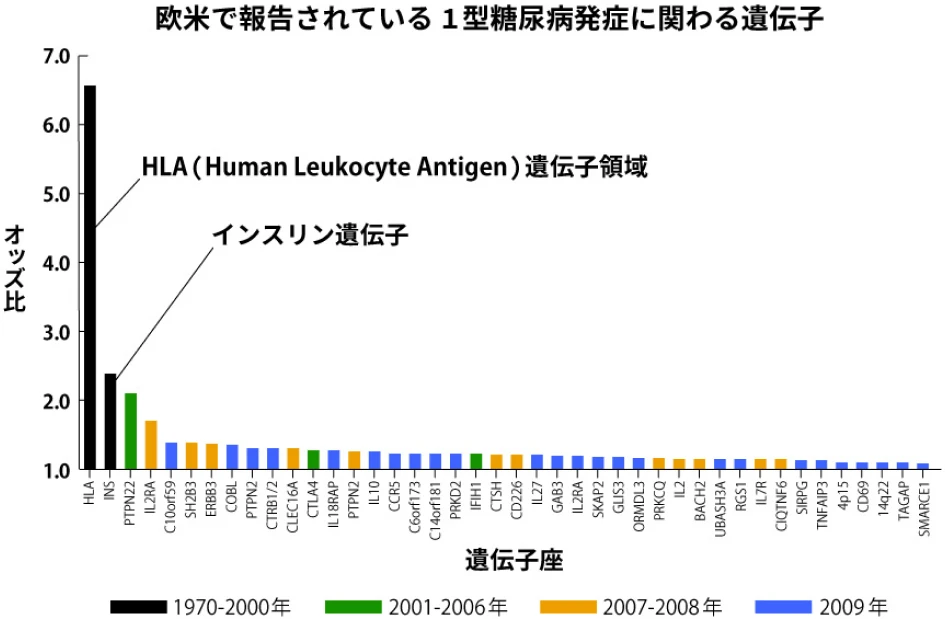
その結果、GWASによって高血圧や糖尿病に関連する多くのリスク遺伝子座が特定されております。このようなGWASによって特定された各遺伝子座の疾患に対する寄与は小さいものの、これらが集積することで多遺伝子性疾患の発症に寄与しています。
連鎖解析
連鎖解析は、家系内のマーカー遺伝子(SNP)の遺伝パターンを調べることで、遺伝地図を作成して疾患の原因遺伝子を特定する方法です。
- ●原理
- ●応用
精子や卵子が作られる際の減数分裂では、相同染色体間で遺伝子の組み換えが起こります。
物理的に近い位置にある遺伝子の組み換え頻度は離れている遺伝子よりも低く、一緒に遺伝する傾向が高くなります。
この頻度を元に遺伝子間の距離を推定して遺伝子地図を作成します。
そこからより近くの(一緒に遺伝する傾向がより高い)マーカー遺伝子見つけて原因遺伝子を絞り込んでゆき、最終的に原因遺伝子を特定します。
連鎖解析は主に単一遺伝子疾患に使用されますが、多遺伝子性形質に寄与するゲノム領域を特定するのにも役立ちます。ただし、解析が複雑になるため、多遺伝子性疾患などの複雑な遺伝形式を示す疾患に対してはGWASほど効果的ではありません。
メンデルランダム化
メンデルランダム化は、観察研究でリスク因子と疾患の因果関係を推測するために遺伝的変異(SNP)を使用する手法です。
- ●概念
- ●応用
薬剤の効果を調べるような場合であれば、ランダムに薬剤を投与した群としなかった群に振り分け、薬と治療成績の因果関係を晃家にすることができます。
しかし多遺伝子性疾患は、環境と遺伝的要因の両方に影響されるため、特定のリスク因子と疾患の因果関係を調べることが困難です。
そこで遺伝子が親から子へ無作為ランダムに分配されることを利用し、リスク因子と疾患の因果関係を推定します。
これは臨床試験のランダム化プロセスを模倣しています。
観察研究で見られる関連が因果関係であるかを明らかにするのに役立ちます。
例えば、高い体重指数(BMI)が糖尿病の原因である因果関係を推定する場合を考えます。まずのか、糖尿病とは関連しないがBMIと相関のある遺伝子(SNP)を見つけます。
この遺伝子を有する割合と糖尿病の割合を評価することで因果関係を推定できます。
統合的アプローチ
現代の研究では、SNP解析、GWAS、連鎖解析、メンデルランダム化を組み合わせて、多遺伝子性疾患の包括的な理解を目指しています。
これらの統合的アプローチは、疾患の遺伝的構造を解明し、潜在的な治療ターゲットを特定するのに役立ちます。
その結果症状に対する対症療法ではなく、原因となるターゲットを標的とした治療を目指しています。
まとめ
高血圧や糖尿病などの生活習慣病は、多遺伝子性疾患は遺伝と環境の複雑な相互作用を示しています。
SNP解析、GWAS、連鎖解析、メンデルランダム化といった先進的な遺伝学研究技術は、この複雑性を解き明かす強力なツールです。
これらの疾患を分子レベルで理解することで、個々の遺伝子構成に基づいた個別化医療への扉が開かれます。
多遺伝子性疾患の深淵を探ることで、人間の健康と疾患の驚くべき複雑性を理解し、遺伝学および環境要因の継続的な研究と革新の必要性が強調されます。